炭酸水素ナトリウム イオン結合 760002-炭酸水素ナトリウム イオン結合
硫酸水素ナトリウムnahso 4,炭酸水素ナトリウムnahco 3 ② 錯塩 錯イオンを含む塩(錯イオンは中心金属が分子またはイオンと配位結合してできた イオンで,次の例のように化学式に を用いて表例えば、炭酸水素ナトリウムnahco3 生じた酢酸ナトリウムは、イオン結合でできている物質であり、水に溶けるとほぼ完全に電離して、酢酸イオンch3cooとナトリウムイオンnaに分かれます。 水は、ohを奪われてしまうと、水素イオンhだけが残ってイオンからなる物質は電気的に中性なので,陰イオンと陽イオンの-と+の数が合うように結合する。 イオンからなる物質の表し方 成分元素の原子の数を最も簡単な比で表した〔 組成式 〕という化学式で表す。 書き方 例)Ca2+とCl- ・・・ Ca2+〔 1

14 電気伝導性から結晶の種類を調べる 化学結合と物質の性質 難易度教材の入手日数準備時間実施時間 1 ヶ月 4 時間 50 分 目的と内容 イオンの生成を電子配置と関連づけて理解すること ま た イオン結合及びイオン結合でできた物質の性質を理解する こと 金属結合
炭酸水素ナトリウム イオン結合
炭酸水素ナトリウム イオン結合-これらの化合物の多くは、金属、非金属、および水素を含む。 しかし、他の例は、イオン結合を介して共有結合した非金属に結合した金属を含む。 両方の種類の化学結合を示す化合物の例を以下に示します。 NaNO 3 硝酸ナトリウム (NH 4 )S 硫化炭酸ナトリウムNa2CO3 106gに含まれるナトリウムイオンNa は何 6 高1の化学の問題です 水を燃焼させると以下の反応が起こる。 2H2O2→2H2O 40gの水素を
/calcium-carbonate-molecule-536230216-57b066703df78cd39cdad367.jpg)



これらの化合物は イオン結合と共有結合の両方を持っています
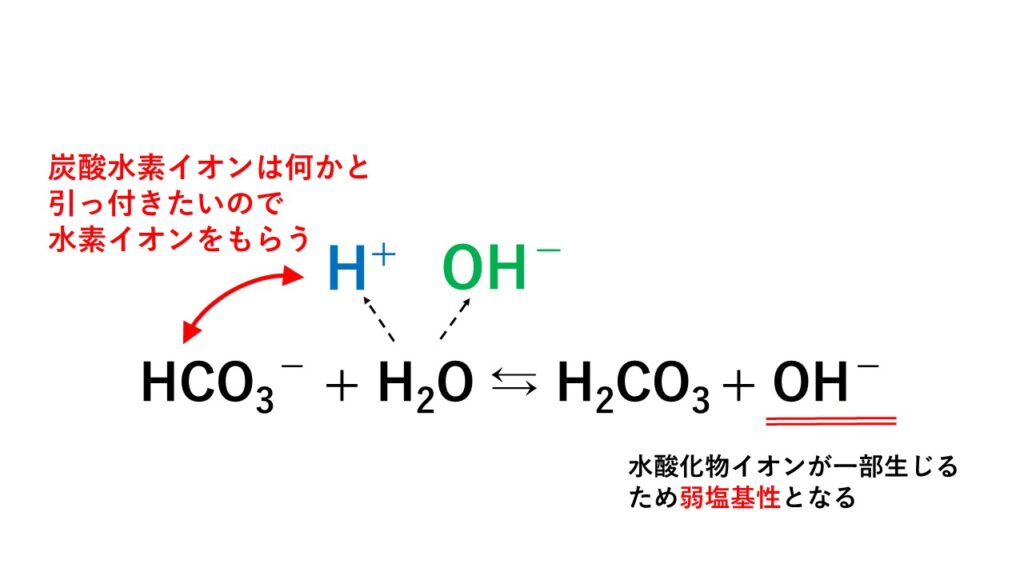
塩化水素 hcl(気) 無色,刺激臭の気体。水に非常によく溶ける。 水溶液は塩酸とよばれる強酸である。共有結合でできた分子である。水に溶けると,電離しイオンになる。 二酸化硫黄 so2 (気) 無色,刺激臭の有毒気体。硫黄の燃焼で生成。炭酸ナトリウムと炭酸水素ナトリウムの混合溶液は溶出力が 強いだけでなく、緩衝能や安定性が高いため、サプレッサ方 式のイオンクロマトグラフィーでは溶離液として広く用いられて きました。しかし、溶出力が高いため、とくに保持時間の早い例) 炭酸水素ナトリウム nahco 3 nahco 3 → na + + hco 3 - 炭酸水素イオン hco 3 - は弱酸のイオンで, h 2 o と反応するので oh - が残る。 hco 3 - + h 2 o → h 2 co 3 + oh - 強酸と弱塩基からできる塩→〔 酸 〕性
H は水素イオン濃度と呼ばれているもので、 溶液1リットル中に含まれている水素イオンH の物質量(mol)を示しています。 式から分かるように、pHは水素イオン濃度H の逆数の常用対数によって表されます。 例えばpH=3の液体は、その液体中に水素イオンH が、1×103 (mol/L)含まれてナトリウムは天然には単体で産出されるこ とはない 2,17 これは,ナトリウムの強い還元性のためで,水素 化合物の水素と置換して水素を遊離する,ハロゲン化合物 からハロゲンを引抜く,酸化物から酸素を引抜くなどの反 応に典型的に見られるそして,特に炭酸水素ナトリウムの熱分解 の実験が,中学の一番はじめに導入されるために反応を単 に暗記と考えやすい。これを水酸化物(オキソ酸)の安定 性に派生させるため,次の順で教えている。 1)酸化物イオンは水の中では単独で存在せず,水
炭酸ナトリウム Na 2 CO 3 は、ガラスやセッケンの製造原料として用いられる他、和紙や染料や医療工業品でも利用されています。 Na 2 CO 3 ・ 10H 2 O → Na 2 CO 3 ・ H 2 O + 9H 2 O 図16 炭酸ナトリウム十水和物 Na 2 CO 3 ・ 10H 2 O の風解 (iv) 炭酸水素 ナト リウム NaHCO 3^ 『高杉製薬製品安全データシート(炭酸水素ナトリウム,重炭酸ソーダ)』 06年4月1日 p3 リンク切れ ^ 玉露缶ドリンクの品質に及ぼす酸化防止剤並びにpH調整剤の影響、大森 薫, 久保田 朗, 大森 宏志、茶業研究報告、Vol1990 (1990) No72・イオン結合はちょうど電荷がつりあうようになります。 なので na₂h₂co₃だと ↓ 2na⁺, 2h⁺, co₃²⁻ ↓ 1が全部で4個, 2が1個となって 全体で2の電荷を帯びてることになってしまいます。 2の炭酸イオンとちょうどつりあうのは 1のナトリウムイオンと1の水素イオンが、それぞ



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 11 Pdf



イオン結晶 化学基礎 高校化学net参考書
例:硫酸水素ナトリウム・NaHSO 4 、炭酸水素ナトリウム・NaHCO 3 塩基性塩 中和したときに、元の塩基の「OH」が、残っている塩カルボン酸 (pK a = 3 ~ 5) は、炭酸 (pK a = 64) より強い酸なので、炭酸塩や炭酸水素塩の水溶液にカルボン酸を加えると、弱酸の二酸化炭素 CO 2 が遊離します。例えば、酢酸 CH 3 COOH は炭酸水素ナトリウム NaHCO 3 と、次のように反応します。ナトリウムと塩(えん) 石鹸に配合されるアルカリ助剤の「炭酸塩」。これは、本当は炭酸ナトリウム(炭酸ソーダ na 2 co 3 )と呼ぶのが正しいのです。 炭酸塩とは「炭酸イオン(co 3 2)を含む化合物の総称」ですから、炭酸ナトリウムのほかにも炭酸カルシウム(caco 3 )や炭酸カリウム(k 2




重曹を使ったウイルス対策メモ 2 5 3 7追記 ゆんたくの輪



炭酸水素ナトリウムについて お世話になっております 高校科学iで 科学 Okwave
酢酸ch3coohは、炭酸h2co3よりも強い酸です。電離度が大きいと言います。電離度の計算式は割愛しますが興味があれば簡単に知ることができます。 炭酸は h2oco2→h2co3 という反応式で表すことができ、二酸化炭素が水に溶けてできた酸です。多くの人は逆反応で出てきた二酸化炭素の泡のことを炭酸水素イオン hco3硫酸イオン so42 炭酸水素ナトリウム nahco3 硫酸水素ナトリウム nahso4 亜硫酸水素ナトリウム nahso3 酢酸ナトリウム ch3coona 二酸化ケイ素 sio23/12 結合エネルギー 6/124次の熱化学方程式が表わしている内容を文章で表せ。Nhk高校講座 化学基礎 第12回 イオン結合とイオン結晶 そして、実はこの電気の力で結晶ができることもある。たとえば食塩の結晶だ。ナトリウムの陽イオンと塩素の陰イオンが電気の力で引きつけ合って結晶になるんだ。 炭酸水素ナトリウム
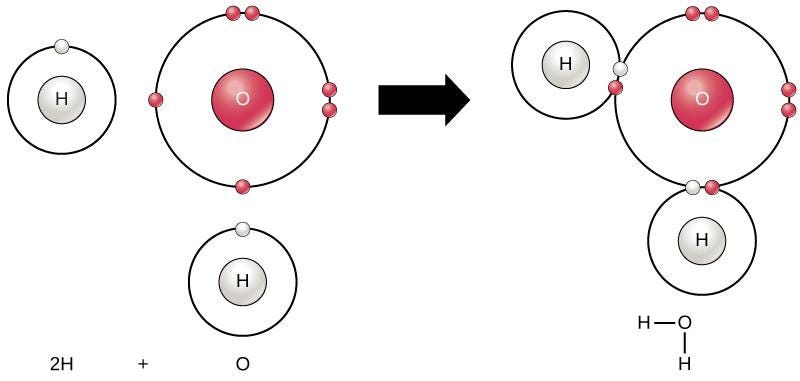



生物学 第2版 第2章 生命の化学的な基盤 Japanese Translation Of Biology 2e By Better Late Than Never Medium




144 55 8 炭酸水素ナトリウム Sodium Bicarbonate 199 詳細情報 分析 試薬 富士フイルム和光純薬
炭酸ナトリウム(na 2co 3)と炭酸水素ナトリウム(nahco 3)を 溶離液に使用する陰イオン分析ではフッ化物イオン(f-)の前 にマイナスピークが出て、微量のf-の分析を行う際に妨害と なることがあります。このマイナスピークはサンプル中の水NH 4 (アンモニウムイオン)とCl(塩化物イオン)の間に生じるイオン結合によって生じる物質なのです。 さて、NaClの結晶を下図に示します。陽イオンのナトリウムイオンと、陰イオンの塩化物イオンが交互に並んでいるのが分かりますね。2 まえがき わが国は世界でも有数の温泉国であり,温泉は国民の保養・療養またはレクリエーショ ンに広く利用されている。




144 55 8 炭酸水素ナトリウム Sodium Hydrogen Carbonate 195 197 197 199 191 詳細情報 分析 常用試薬 ラボウェア 試薬 富士フイルム和光純薬



くらしに大活躍 あなたもレッツ 重曹博士 三郷市公式サイト
化学辞典 第2版 亜硫酸ナトリウムの用語解説 ⅠNa2SO3().水酸化ナトリウムの濃水溶液に二酸化硫黄を通気し冷却すると,七水和物が沈殿する.この結晶を約50 ℃ に加熱すると無水物が得られる.炭酸ナトリウム水溶液と二酸化硫黄でつくった亜硫酸水素ナトリウムを,計算量の炭酸水に溶けにくいと水酸化物イオンも出ないからアルカリ性も弱くなる ゲスト 1年以上前 炭酸水素ナトリウムの方が水に溶けにくいのは、炭酸ナトリウムよりも水にくっつきにくいから ここら辺は高校の分野だからぼやっと覚えるくらいでいいかも この度の塩化物イオン濃度を設定し,溶液Sm はその 1/10 の濃度とした。また,塩化物イオン,炭酸 水素イオン共存下での溶脱挙動を把握するため に,それぞれの濃度を変化させた4 種類の塩化 ナトリウム・炭酸水素ナトリウム混合溶液を作




炭酸水素ナトリウム Wikipedia




14 電気伝導性から結晶の種類を調べる 化学結合と物質の性質 難易度教材の入手日数準備時間実施時間 1 ヶ月 4 時間 50 分 目的と内容 イオンの生成を電子配置と関連づけて理解すること ま た イオン結合及びイオン結合でできた物質の性質を理解する こと 金属結合
07 炭酸水素ナトリウムの成分元素 08 2-メチル-プロパノールの三態とヨウ素の昇華 物質の構成粒子 09 ナトリウム の性質 21 金属樹の生成と金属のイオン炭酸水素ナトリウム 正解:5 解説:物質の結合はイオン結合、共有結合、金属結合に大別できる。正に荷電した陽イオン と負に荷電した陰イオンがクーロン力で結合することをイオン結合と称す。炭酸水素ナトリ ウムはナトリウムイオン(イオン交換樹脂はhco 3 − に結合することでまれにhco 3 炭酸水素ナトリウム(nahco 3 )を用いたアシデミアの治療適応があるのは,特定の状況のみであり,その他の状況ではおそらく有害である。



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 11 Pdf



100 101 100 110 解説一覧 問101 有機化合物 1 5 が それぞれ 100mg 溶解している ジエチルエーテル エーテル 溶液 100ml について エーテルと同体積の各水溶液を用いて 分液ロートによる以下の抽出操作を行った 主としてエーテル層aに合まれる
Na(ナトリウム)のようにイオン化傾向の大きな金属は、常温の水とも反応し水酸化物にな oh(水酸化物イオン)と結合してca(oh) ルシウムイオン)とhco3(炭酸水素イオンまたは重炭酸イオン)を生じる。そのcahco3亜鉛 水酸化ナトリウム イオン反応式 化学反応式 be(oh)2、zn(oh)2およびfe(oh)3を含む他の両性水酸化物についても同様のタイプの水素結合が提案されている 化学量論的なa3miii(oh)6、a2miv(oh)6およびamv(oh)6を有する多くの混合水酸化物が知られている




なぜクエン酸は酸性で 重曹はアルカリ性なのか 両者の意外な関係とは 日本霜降社



炭酸水素ナトリウム You Iggy




ナトリウムの流れ Diagram Quizlet




炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




05 物質と化学結合 イオン結合 Chemistry Quiz Quizizz




イオン結合とイオン結晶




細胞培養とインキュベーター Co2を使う理由




13 号 クエン酸 重曹を含む錠剤及びその製造方法 並びに 高濃度の重炭酸イオンを含んだ美容用材及び該美容用材を使用した美容方法 Astamuse



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 11 Pdf




イオン結合とイオン結晶



144 55 8 炭酸水素ナトリウム Sodium Hydrogen Carbonate 195 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説




炭酸水素ナトリウム Wikipedia



Http Www Yoshida Pharm Jp Files Interview 408 Pdf




化学 酸性塩の水溶液 オンライン無料塾 ターンナップ



3




保存版 重曹水を飲むとどんな効果があるの ウォーターサーバー ピュアハワイアン のwebマガジン




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット



2




なぜクエン酸は酸性で 重曹はアルカリ性なのか 両者の意外な関係とは 日本霜降社



炭酸水素ナトリウム



炭酸水素ナトリウムって弱酸の塩なのか塩基性かどっちなんですか Yahoo 知恵袋




19 号 炭酸水素ナトリウムのin situ変換で促進されたアミン薬物の経皮送達 Astamuse
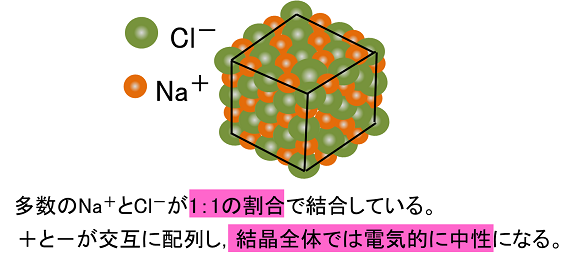



イオン結合とイオンからなる物質




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




Web教材イラスト図版工房 R C1m 炭酸水素ナトリウムを加熱する前後の質量の変化 2



イオン結合とイオンからなる物質



中2 理科1 炭酸水素ナトリウムの熱分解 成城中学校 高等学校




炭酸水素ナトリウムはなぜアルカリ性を示すのか 反応式を使ってわかりやすく解説 ジグザグ科学 Com




Nahco3はなぜ塩基性なんですか 酸性じゃないんですか Clearnote
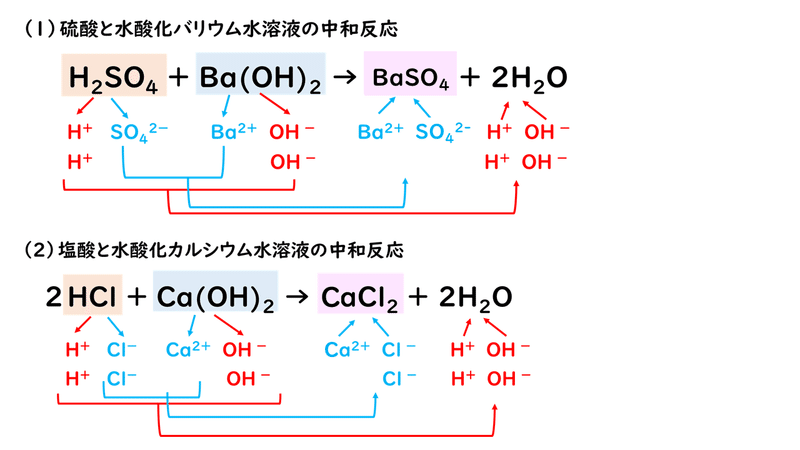



6 4 塩とその性質 おのれー Note




なぜ 炭酸水素ナトリウムは分子をつくる物質ではないのでしょうか Clearnote
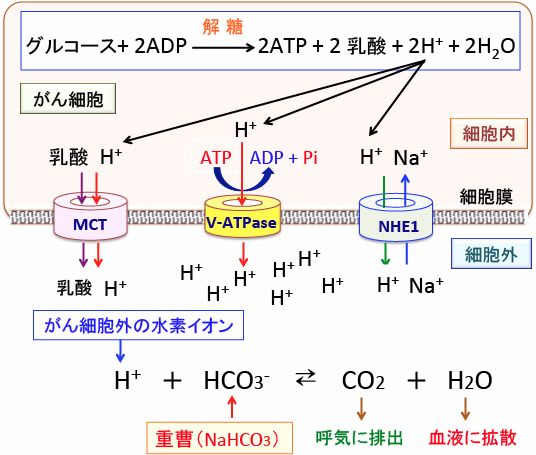



528 がん組織のアルカリ化と抗がん剤治療 その2 重曹 重炭酸ナトリウム 治療 漢方がん治療 を考える




なぜ 炭酸水素ナトリウムは分子をつくる物質ではないのでしょうか Clearnote



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する
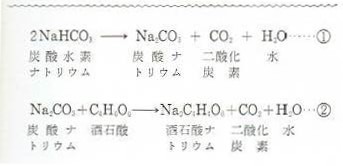



炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説
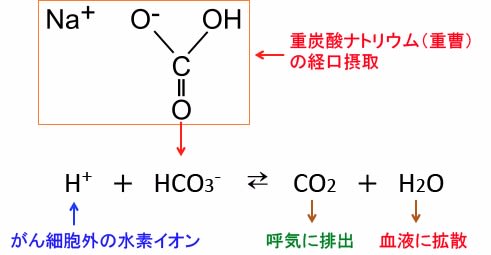



666 がんのアルカリ療法 その3 重曹 重炭酸ナトリウム とトリス塩基 漢方がん治療 を考える




中3化学 化学式の作り方 知識問題 中学理科の問題パターンと練習問題




炭酸ナトリウム Wikipedia



重曹に水を加えると炭酸水素ナトリウムと水と二酸化炭素が出来るという化学反応式は Yahoo 知恵袋
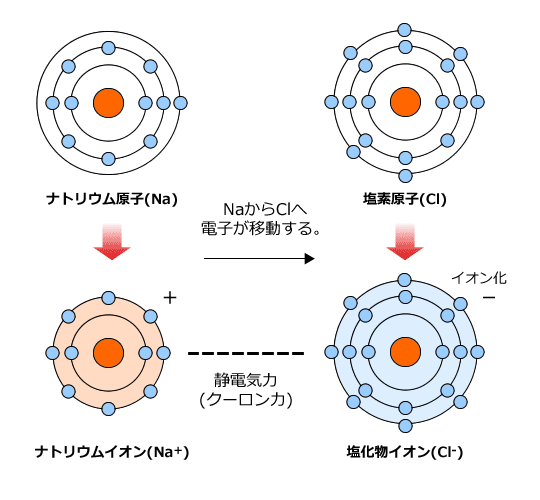



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム
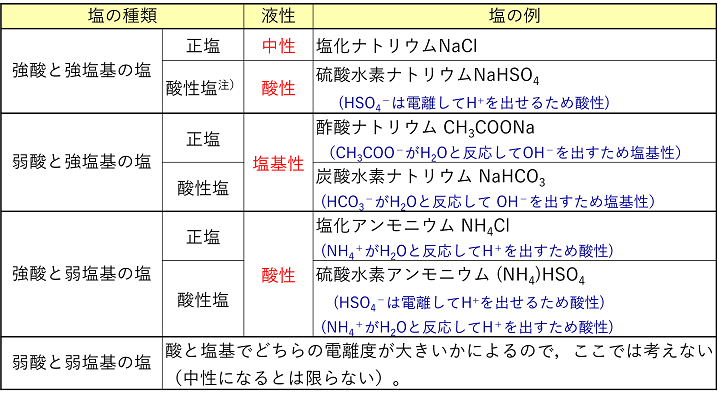



塩
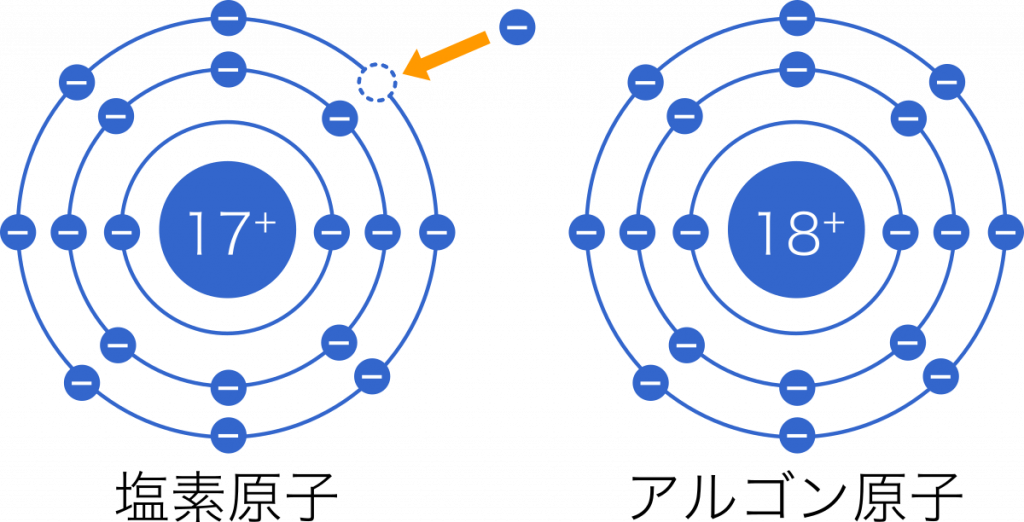



高校化学基礎まとめ イオン Mm参考書



100 101 100 110 解説一覧 問101 有機化合物 1 5 が それぞれ 100mg 溶解している ジエチルエーテル エーテル 溶液 100ml について エーテルと同体積の各水溶液を用いて 分液ロートによる以下の抽出操作を行った 主としてエーテル層aに合まれる
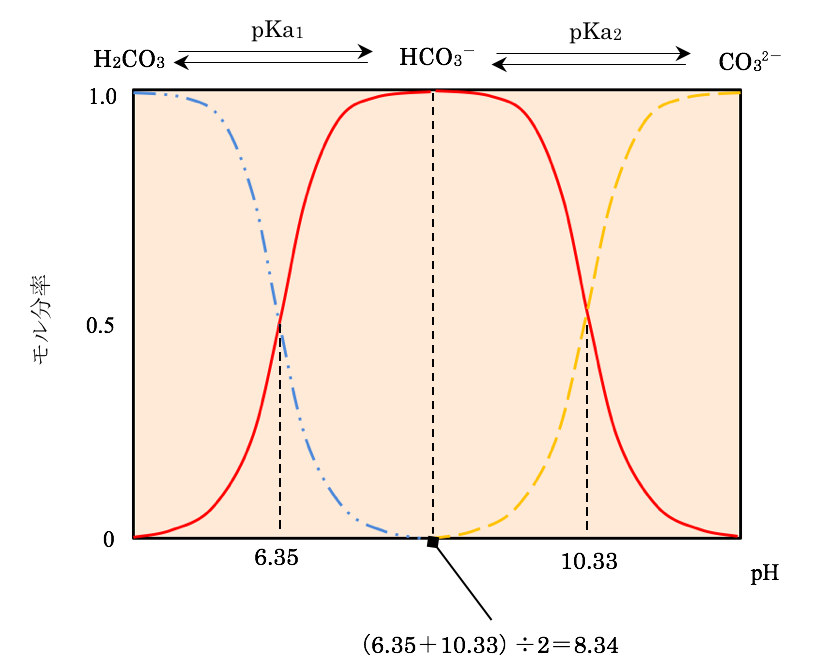



Phの測定 溶液のph Yakugaku Lab




炭酸水素ナトリウムの熱分解 中学理科 By かたくり工務店 マナペディア
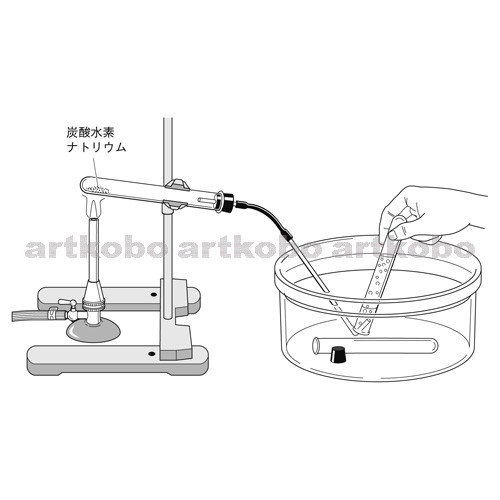



Web教材イラスト図版工房 R C1m 炭酸水素ナトリウムの加熱 2




イオン結合とイオンからなる物質




Na2co3 Clear



中2化学 炭酸水素ナトリウムの熱分解 Hiromaru Note
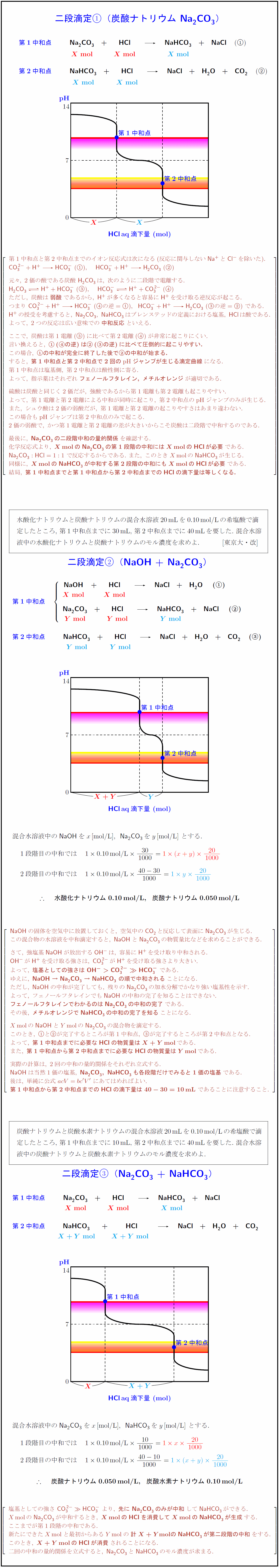



高校理論化学 二段滴定 炭酸ナトリウムna Co Naoh Na Co Na Co Nahco 受験の月



実習6 2カップル イオン結合 を作る 3年理科 化学 Takaの授業記録18



2




19 号 炭酸水素ナトリウムのin situ変換で促進されたアミン薬物の経皮送達 Astamuse



炭酸水素ナトリウム You Iggy
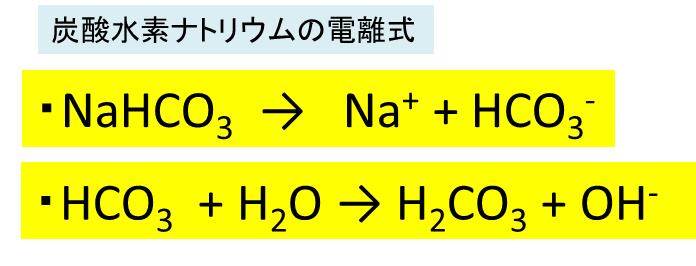



炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



重曹 クエン酸 炭酸水 ひらけごま
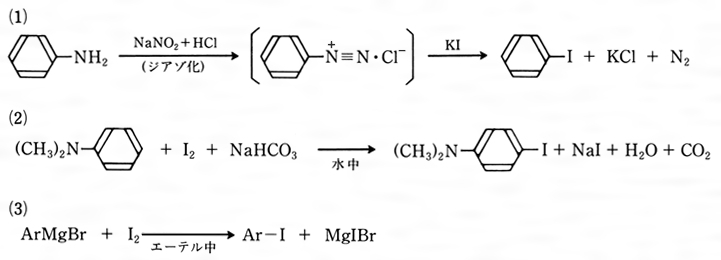



ヨウ素化とは コトバンク
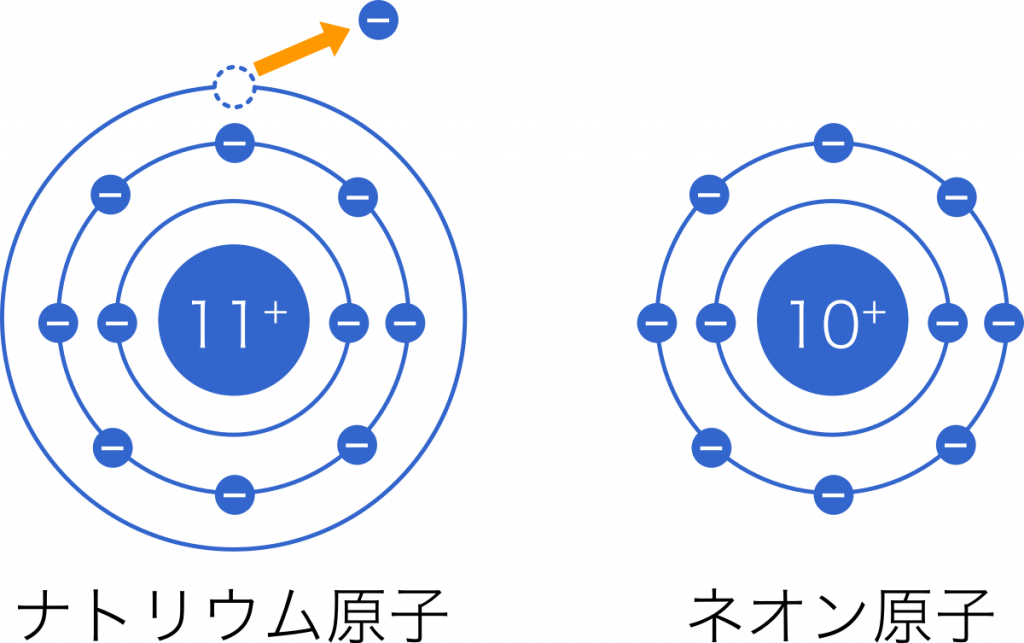



高校化学基礎まとめ イオン Mm参考書




あなたが知らない共有結合 イオン結合 金属結合の真の姿 化学受験テクニック塾



2




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




共有結合 イオン結合 金属結合は同じ 違いと見分け方を解説




No 32 炭酸水素ナトリウム 重曹 摂取による効果まとめ




本当に知らなきゃ損なのか 重曹の活用法を化学的に考察してみる Reasonable Way Of Life




炭酸水素ナトリウム Wikipedia



ケーキの中の化学 エセ化学者の理科の学校
/calcium-carbonate-molecule-536230216-57b066703df78cd39cdad367.jpg)



これらの化合物は イオン結合と共有結合の両方を持っています
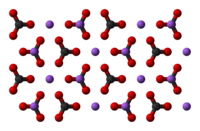



炭酸ナトリウム Wikipedia



イオン結晶 化学基礎 高校化学net参考書




炭酸水素ナトリウムの化学反応式 超絶な覚え方 Youtube
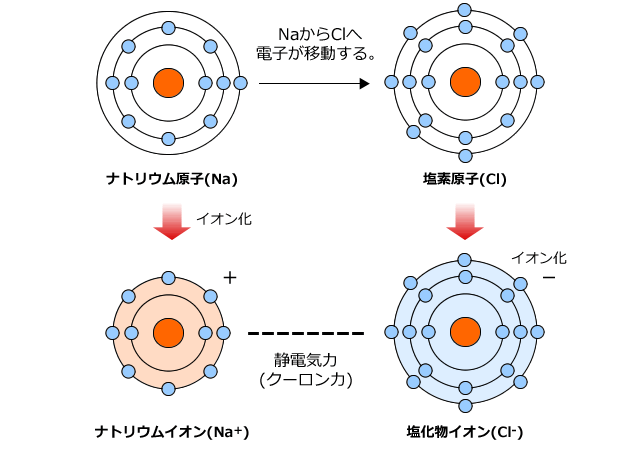



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム



理科の質問です 化学反応式を作るとき 化学式の順番は何でもいいん Yahoo 知恵袋




フェノール類に関する正誤問題 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc



実習6 2カップル イオン結合 を作る 3年理科 化学 Takaの授業記録18




7 5w V 炭酸水素ナトリウム溶液 7 5w V Sodium Bicarbonate Solution 195 詳細情報 培養 試薬 富士フイルム和光純薬



炭酸水素ナトリウムの分解を化学反応式で教えてください 写真の黄色 Yahoo 知恵袋



炭酸水素ナトリウムは何が結合しているのですか co2na oh Yahoo 知恵袋



授業 炭酸水素ナトリウムの熱分解 私の 理科教師日記



1




生物学 第2版 第2章 生命の化学的な基盤 Japanese Translation Of Biology 2e By Better Late Than Never Medium



Http Www Yoshida Pharm Jp Files Interview 299 Pdf
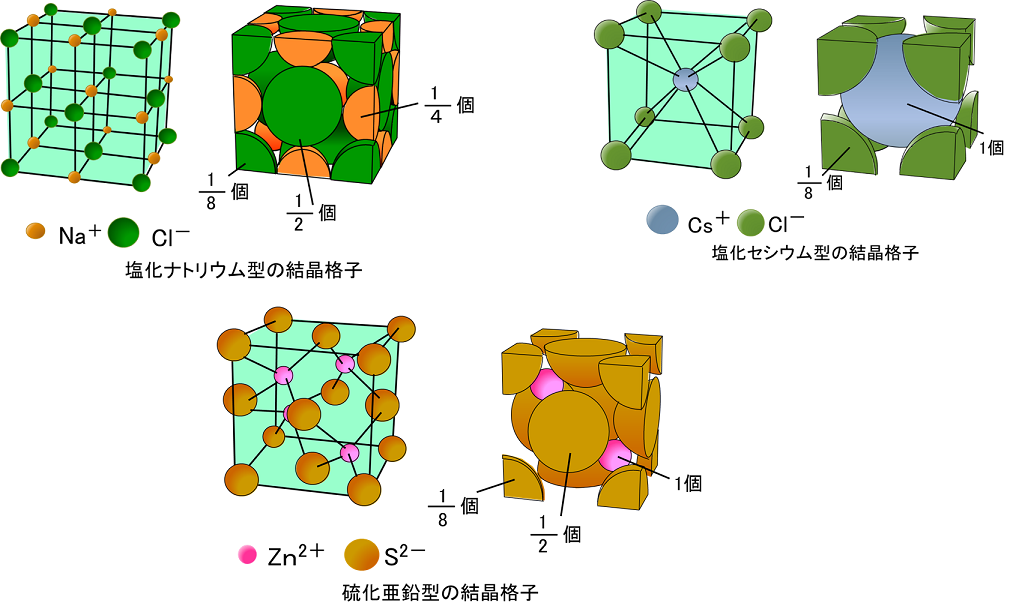



イオン結合とイオンからなる物質




144 55 8 炭酸水素ナトリウム Sodium Hydrogen Carbonate 195 197 197 199 191 詳細情報 分析 常用試薬 ラボウェア 試薬 富士フイルム和光純薬
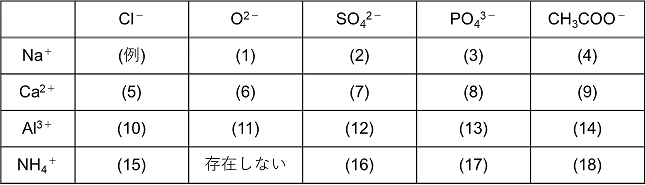



イオン結合とイオンからなる物質



炭酸水素ナトリウム You Iggy
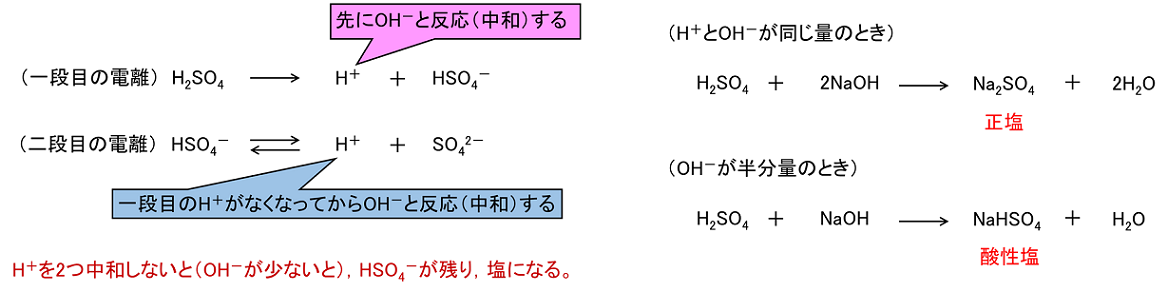



塩




中2化学 炭酸水素ナトリウムの熱分解 Hiromaru Note



1




炭酸水素ナトリウム Wikipedia




化学結合の種類 概論




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



コメント
コメントを投稿